フラキセチンは小胞体ストレスの活性化、ミトコンドリアを介したアポトーシスの誘導、活性酸素の生成を通じて子宮内膜症病変を軽減する
Fraxetin reduces endometriotic lesions through activation of ER stress, induction of mitochondria-mediated apoptosis, and generation of ROS Phytomedicine 2023; 123: 155187
子宮内膜症に対するフラキセチンの治療効果をin vitroおよびin vivoの研究で実証した。In vitroの解析では、子宮内膜症上皮細胞株に対するフラキセチン処理が増殖を抑制し、その遊走能を抑制することを示した。一方で、不死化された子宮内膜間質細胞株へのフラキセチン処理が、その増殖に影響を与えなかったことから、フラキセチンは子宮内膜症細胞の増殖を特異的に抑制するとした。In vivoの解析では、子宮内膜症モデルマウスを作成し、フラキセチンを経口投与することで、子宮内膜症病変の実質的な退縮、接着分子の発現、抗炎症効果を確認した。そのメカニズムは、フラキセチンによるtiRNAHisGTGの発現増強を介したミトコンドリアのアポトーシスの誘導および活性酸素の生成としている。
Graphical Abstract
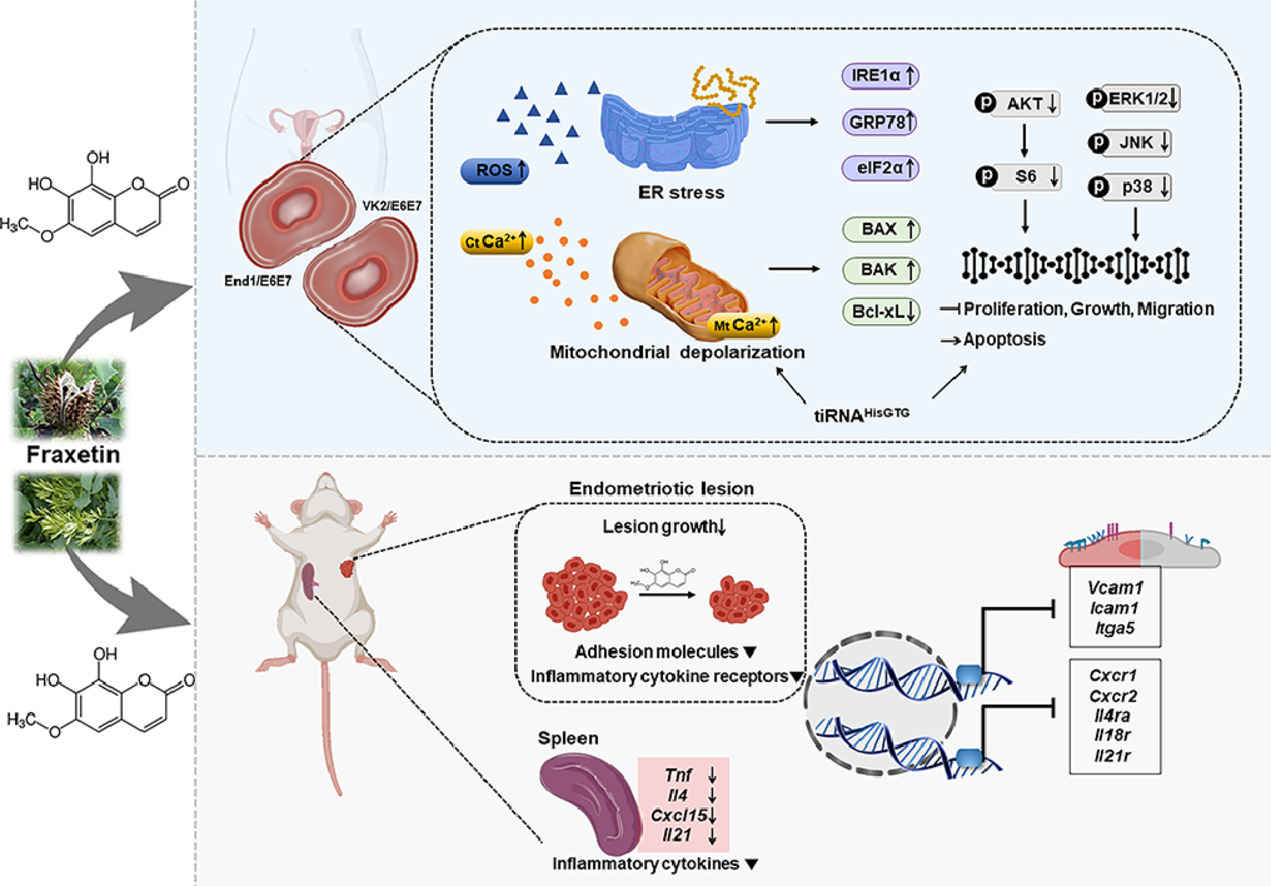
子宮内膜症におけるフラキセチンの強力な治療メカニズムを図にまとめた。上の図は培養細胞を用いた解析により明らかとなったフラキセチンが子宮内膜症細胞を退縮させるメカニズムである。活性酸素の増加による小胞体ストレスと、ミトコンドリアの脱分極からのアポトーシスが明らかになった。下の図は子宮内膜症モデルマウスへのフラキセチン経口投与による治療効果のメカニズムである。移植した子宮内膜症病変の退縮と、脾臓での炎症系サイトカインの減少を明らかにした。
Abstract
背景
フラキセチンは、Fraxinus rhynchophylla(チョウセントネリコと呼ばれる樹木)から得られる植物性化学物質で、その抗炎症および抗線維化の特性で知られています。しかし、フラキセチンはQOLの低下や不妊の原因となる良性の生殖器疾患である子宮内膜症の進行に対する調節作用を持っている事は、あまり知られていない。
仮説/目的
我々は、フラキセチンが子宮内膜症に対して治療効果を持つ可能性があると考え、ミトコンドリア機能と転写開始RNA(transcription initiation RNA : tiRNA)制御の基礎となるメカニズムを解明することを目的とした。
研究デザイン
子宮内膜症モデル動物および細胞(End1/E6E7およびVK2/E6E7)を用いて、フラキセチンの作用機序を明らかにした。
方法
自家子宮内膜症モデルを樹立し、病変サイズ縮小に対するフラキセチンの効果を解析した。増殖、細胞周期、遊走、アポトーシス、ミトコンドリア機能、カルシウム流出、活性酸素種(ROS)を含む細胞ベースのアッセイを実施。さらに、フラキセチンのシグナル伝達はウェスタンブロッティングおよびqPCR分析によって証明した。
結果
フラキセチンは、P38/JNK/ERKマイトジェン活性化プロテインキナーゼ(MAPK)およびAKT/S6経路を不活性化することにより、増殖および遊走を阻害した。フラキセチンはミトコンドリア膜電位を散逸させ、酸化的リン酸化(OXPHOS)をダウンレギュレートし、酸化還元とカルシウム恒常性を妨害した。さらに、小胞体ストレスと内在性アポトーシスを誘発した。さらに、tiRNAHisGTGの阻害剤をトランスフェクションすることで、子宮内膜症におけるtiRNAHisGTGの機能的役割を明らかにした。最後に、子宮内膜症マウスモデルを確立し、子宮内膜症病変の退縮と炎症に伴う接着分子のダウンレギュレーションを検証した。
結論
本研究は、フラキセチンがミトコンドリアとtiRNAを標的とする新規治療薬であることを示唆している。本研究は、tiRNAHisGTGがミトコンドリア機能と細胞運命に関与するメカニズムを実証した初めての研究であり、子宮内膜症の進行に対する非ホルモン的方法として応用可能である。


コメント
植物由来の物質であるフラキセチンが子宮内膜症の治療薬として有用である可能性を示した研究です。特に着目すべきはその特異性と経口摂取での効果です。正常細胞には影響がなく、病変細胞のみ退縮させるというのは理想的な効果であることは言うまでもありません。また、細胞レベルでは可能な処理濃度でも生体内では実現が難しい、なんてことはよくありますが、本研究ではマウスにフラキセチンを経口投与して、現行の治療薬であるdienogestと同等の効果を示しています。植物性化合物であるため医薬品ではなく食品として利用できると考えられ、今後のさらなる研究による臨床応用が期待されます。